In de fase III-studie VANISH 306 werd de effectiviteit van het orale geneesmiddel ibrexafungerp onderzocht bij vrouwen met vulvovaginale candidiasis (VVC). Op één dag werden twee tabletten ibrexafungerp ingenomen of twee placebotabletten. Bij een opvolgbezoek, ongeveer een week later waren meer dan 60% van de vrouwen behandeld met ibrexafungerp klinisch genezen, ten opzichte van circa 40% met placebo. Daarnaast was ook het percentage vrouwen dat mycologische eradicatie vertoonde significant verhoogd met ibrexafungerp.
Vulvovaginale candidiasis (VVC) is de tweede meest voorkomende veroorzaker van vaginitis wereldwijd.1 De vaginale schimmelinfectie VVC wordt in circa 90% van de gevallen veroorzaakt door de gistachtige schimmel Candida albicans. De epidemiologie is sterk verschillend tussen landen, met gerapporteerde incidenties tussen 12,1% en 57,3%.2 Momenteel zijn er fungistatische middelen in de azolenklasse beschikbaar ter behandeling van VVC. Orale en intravaginale middelen zijn beschikbaar voor patiënten met een ongecompliceerde ziekte. Wanneer de schimmelinfectie echter veroorzaakt wordt door een azolresistente Candida, of de patiënt een contra-indicatie heeft voor het gebruik van azolen, zijn behandelopties zeer beperkt. Een nieuwe behandelmogelijkheid voor VVC-patiënten is ibrexafungerp. De effectiviteit van dit geneesmiddel werd onderzocht in de fase III-studie VANISH 306.3
VANISH 306 was een gerandomiseerde dubbelblinde fase III-studie waarin werd bekeken of de werkzaamheid van de triterpeen ibrexafungerp superieur was aan een placebo. Dit werd onderzocht in 19 onderzoekscentra in de Verenigde Staten en 18 centra in Bulgarije, bij vrouwelijke patiënten met acute VVC en een vulvovaginale klachtenscore (VVS-score) van 4 of hoger bij aanvang van de studie. De deelnemers werden 2:1 gerandomiseerd naar ibrexafungerp (tweemaal 150 mg, op één dag) of placebo (tweemaal placebotablet, op één dag). Patiënten hielden de vulvovaginale symptomen bij in een dagboek, net als gegevens over de ingenomen dosis, bijwerkingen en eventueel gelijktijdig medicijngebruik. De patiënten continueerden totdat zij toestemming introkken, onacceptabele toxiciteit ervaarden of zij niet naar het follow-upbezoek gingen.
Binnen de studie werden de vrouwen onderzocht bij aanvang van de studie, bij het ‘test-of-cure’(TOC)-bezoek (na 7-14 dagen) en bij het follow-upbezoek (na 21-30 dagen). Hierbij werden de dagboeken gelezen en werd een fysiek onderzoek uitgevoerd om de VVC-klachten te bepalen bij baseline, het TOC-bezoek en bij het follow-upbezoek wanneer de patiënt nog symptomatisch was. Patiënten scoorden de symptomen branderigheid, jeuk en irritatie en de onderzoekers beoordeelden tekenen van oedeem, erytheem en ontvelling/fissuren op een schaal van 0-3 (absent tot ernstig). Hiernaast ondergingen patiënten mycologisch onderzoek. Dit omvatte een directe microscopische beoordeling met 10% kaliumhydroxide en schimmelculturen. De kaliumhydroxidetesten werden bij screening uitgevoerd en bij het TOC- en follow-upbezoek wanneer de symptomen aanhielden of terugkeerden. Bovendien werden vulvovaginale samples onderzocht op bacteriële vaginosis en Trichomonas vaginalis. Bij verdenking op het herpesvirus, Neisseria gonorrhoeaeof Chlamydia trachomatis werd dit ook nader bekeken. Samples van de schimmelculturen werden afgenomen bij screening, bij het TOC-bezoek en voor het starten van een doorbraak-antischimmelmiddel.
Het primaire eindpunt van de studie was het percentage patiënten dat klinisch genezen was (VSS=0) bij het TOC-bezoek. Secundaire eindpunten includeerden onder meer het percentage patiënten met mycologische eradicatie bij het TOC-bezoek en het percentage patiënten dat klinisch genezen was én mycologische eradicatie vertoonde bij het TOC-bezoek (=algeheel succes).
Totaal werden 449 patiënten opgenomen in de ‘intention-to-treat’(ITT)-populatie en gerandomiseerd naar ibrexafungerp (n=298) of placebo (n=151). Hiervan vielen er 272 (ibrexafungerp n=188, placebo n=84) binnen de aangepaste ITT-populatie (‘modified ITT’, mITT) die bij aanvang van de studie positief testen op Candida en vervolgens minstens één dosis van de behandeling ontvingen. Patiënten in mITT waren in beide behandelarmen mediaan 32 jaar oud, veelal wit (81-82%), circa 15% had obesitas (≤35 kg/m2 88,8% bij ibrexafungerp en 82,1% bij placebo) en minder dan 1 op de 10 had last van diabetes mellitus. Van deze patiënten die positief testen op Candida, was dit in de meeste gevallen C. albicans (87,8% in de ibrexafungerp-arm en 90,5% in de placebo-arm). Verder werden onder meer gevallen gezien van C. glabrata (respectievelijk 10,6% en 9,5%) C. tropicalis (1,6% en 3,6%) en C. kefyr (1,6% en 1,2%). Er werden geen fluconazol-resistente versies van C. albicans gezien bij aanvang van de studie en ook niet bij het TOC-bezoek.
Ibrexafungerp vertoonde superieure effectiviteit ten opzichte van placebo op het primaire eindpunt en de belangrijkste secundaire eindpunten. Het percentage patiënten dat klinisch genezen was ten tijde van het TOC-bezoek was hoger met ibrexafungerp (63,3%) ten opzichte van placebo (44,0%; relatief risico [RR]: 1,38; 95%-BI: 2,073-1,783; p=0,007).
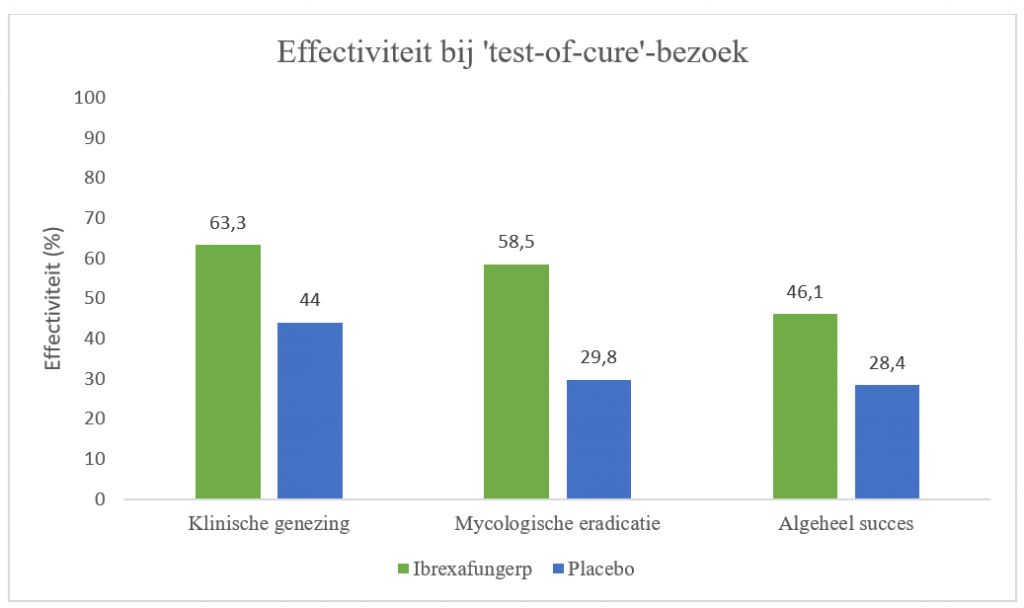
Dit resultaat werd ook gezien in de groep patiënten met een C. albicans-infectie (RR: 1,35; 95%-BI: 1,046-1,744; p=0,013). Daarnaast was het percentage patiënten met klinische verbetering (VVS ≤1) bij het TOC-bezoek ook hoger met ibrexafungerp dan met placebo (72,3% versus 54,8%; RR [95%-BI]: 1,28 [1,043-1,570]; p=0,010). Bij het follow-upbezoek waren de symptomen van 73,9% van de vrouwen geheel verdwenen bij behandeling met ibrexafungerp, dit was het geval bij 52,4% van de placebobehandelde patiënten (p=0,001). Bij patiënten met C. albicans-infectie verdwenen symptomen bij 77,0% na behandeling met ibrexafungerp ten opzichte van 52,6% met placebo (p<0,001).
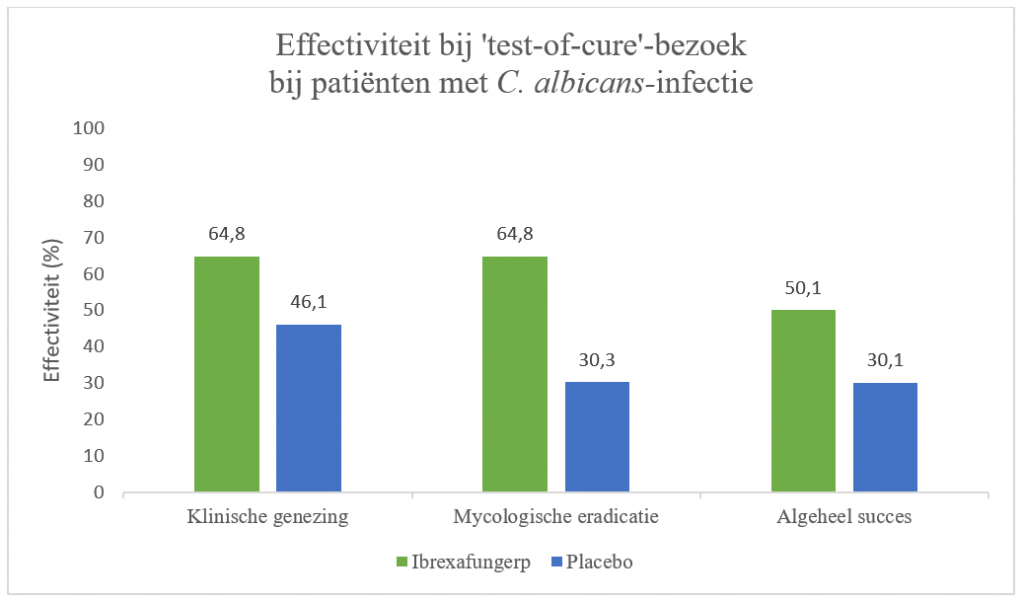
Tevens was het percentage patiënten met mycologische eradicatie hoger ten tijde van TOC in de experimentele groep dan met placebo (RR [95%-BI]: 1,85 [1,329-2,583]; p<0,001). Dit gold ook voor patiënten positief voor C. albicans (RR [95%-BI]: 2,01 [1,439-2,814]; p<0,001). Het algehele therapeutische succes was daarnaast ook hoger met ibrexafungerp in vergelijking met placebo (RR [95%-BI]: 1,48 [1,038-2,113]; p=0,022). Dit was ook het geval bij C. albicans-positieve vrouwen (RR [95%-BI]: 1,56 [1,01-2,219]; p=0,009).
Over het algemeen werd ibrexafungerp goed getolereerd; 14,8% van de patiënten ontwikkelde een behandelingsgerelateerde bijwerking die behandeling behoefde, ten opzichte van 4,0% in de placebogroep. De meest geziene bijwerkingen waren hierbij gastro-intestinaal en mild tot matig-ernstig van aard. Bijwerkingen die bij ≥2% van de patiënten voorkwamen waren misselijkheid en diarree. Bij twee participanten leidden bijwerkingen tot een dosis-interruptie in de ibrexafungerp-behandeling. Er werden geen overlijdens gerapporteerd.
Uit de VANISH 306-studie bleek een superieure effectiviteit van ibrexafungerp ten opzichte van placebo in het aantal vulvovaginale candidiasispatiënten dat klinisch geneest en mycologische eradicatie vertoont. Dit was zowel het geval bij patiënten met een C. albicans-infectie als met infecties met andere schimmels van de Candida-familie. Tevens werd een gunstig bijwerkingenprofiel gezien bij deze behandeling.
Referenties